•与标准治疗相比,肿瘤电场治疗(TTFields, Tumor Treating Fields)联合标准治疗提供了具有显著统计学意义和临床意义的3个月中位总生存期的改善,且未增加系统性毒性。
•肿瘤电场治疗联合免疫检查点抑制剂在中位总生存期上实现,的8个月的提升。
•数据将于今日在2023年美国临床肿瘤学会(ASCO)年会上发表。
再鼎医药有限公司(纳斯达克股票代码:ZLAB;香港联交所股份代号:9688)和Novocure(纳斯达克股票代码:NVCR)今日在2023年美国临床肿瘤学会(ASCO)年会上,公布了一项评估TTFields联合标准治疗用于非小细胞肺癌(NSCLC)的 LUNAR 临床III 期研究的阳性结果。当 TTFields 联合标准治疗,LUNAR 研究达到了其主要终点,中位总生存期(OS)有显著统计学意义和临床意义的3个月改善(HR:0.74,P = 0.035)。
随机接受TTFields联合标准治疗的患者(n=137)的中位OS为13.2个月,而仅接受标准治疗的患者(n=139)为9.9个月。
在免疫检查点抑制剂(ICI)亚组中证明了TTFields对OS产生的巨大获益。随机接受TTFields和医生选择的ICI的患者(n=66)的中位OS为18.5个月,而仅接受ICI治疗的患者的中位OS为10.8个月 (n=68;HR=0.63;P=0.03)。
随机接受TTFields和多西他赛(n=71)治疗的患者具有积极的生存趋势,中位OS为11.1个月,而单独接受多西他赛治疗的患者(n=71)为8.7个月。
TTFields耐受性良好,没有增加系统毒性,3 级(无4级或5级)设备相关不良事件发生率较低。
主要研究者、埃默里大学Winship癌症研究所研究员和医学肿瘤学专家、亚特兰大埃默里大学医学院血液与肿瘤学科胸部医学肿瘤项目主任、Ticiana Leal副教授表示:"LUNAR研究的结果非常令人鼓舞。我对这一进展以及这种创新疗法的潜力感到激动,它可以帮助许多在含铂方案治疗后需要新治疗选择的转移性肺癌患者,且不会增加系统性毒性。"
中山大学肿瘤防治中心张力教授表示:"LUNAR研究展示出的对总生存期的显著改善是,突破性的。肺癌是中国癌症相关死亡的主要原因,而非小细胞肺癌则是肺癌中最常见的类型。对于在一线使用含铂方案治疗后进展的患者,预后往往非常差。我很高兴这种新型的非侵入性医疗器械可以为中国转移性非小细胞肺癌患者带来显著获益。"
各队列之间患者基线特征达到了很好的平衡:中位年龄为64岁(范围22-86);65%为男性;96%的ECOG表现状态为0-1。患者在北美 (30%)、西欧 (30%)、东欧 (30%) 和东亚(9%)的研究中心入组。接受TTFields联合标准治疗的患者的一年生存率为53%,而仅接受标准治疗的患者为42%(P=0.04)。一项具有里程碑意义的分析表明,接受过TTFields联合标准治疗的患者三年生存率提高了近三倍,达到18%,而仅接受标准治疗的患者为7%(P=0.015)。接受TTFields联合标准治疗的患者的中位无进展生存期(PFS)为4.8个月,而单独接受标准治疗的患者为4.1个月。
在随机分组的患者中,89%的患者此前接受过一种系统性治疗,31%接受过ICI 治疗(58%的患者随机分配至多西他赛队列,2%的患者随机分配至ICI 队列)。2017年,在进行LUNAR研究期间,多个ICI被批准用于一线NSCLC的治疗,随后在接受ICI治疗的区域收集了PD-L1表达数据。全球151名患者(55%)可评估肿瘤细胞PD-L1阳性细胞比例评分(TPS),并且在队列中非常均衡。在接受ICI治疗并测量肿瘤比例评分的所有患者中,63%的PD-L1表达 >1%,这与真实世界数据一致。PD-L1表达数据收集来自美国研究中心入组的83%的患者(83名患者中的 69名),并且在四个队列中得到了很好的平衡。
PD-L1状态:
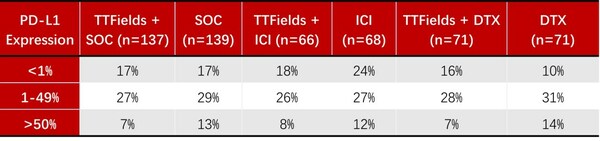
DTX = 多西他赛;ICI = 免疫检查点抑制剂;SOC = 标准治疗
Novocure已递交LUNAR临床研究结果,发表在,别同行审阅的医学期刊上。LUNAR临床研究数据有望作为2023年下半年向美国食品药品监督管理局(FDA) 提交上市前批准(PMA)的基础。再鼎医药为LUNAR研究的中国部分做出了贡献,计划在Novocure向FDA递交后,向国家药品监督管理局(NMPA)提交上市许可申请 (MAA)。
Novocure 执行主席 William Doyle表示:"感谢所有的患者及家属以及护理人员参与LUNAR研究。感谢Leal博士和我们所有的研究人员,感谢他们在推进患者护理方面的专业知识和奉献精神。LUNAR研究结果代表了转移性非小细胞肺癌治疗领域的巨大进步。LUNAR研究证明了 TTFields在提高癌症患者生存率,解决亟需未得到满足的需求上,具有广泛和多用途的潜力。我们对LUNAR研究的结果备受鼓舞,并正在迅速向前推进,使 TTFields造福转移性非小细胞肺癌患者。"
再鼎医药创始人、董事长兼首席执行官杜莹博士表示:"中国每年约有74万新发非小细胞肺癌患者,大多数患者确诊时已是晚期。LUNAR 研究结果表明,TTFields具有显著延长许多晚期铂类耐药NSCLC患者生存期的潜力。我们很高兴能够为LUNAR研究做出贡献,我们期待与Novocure合作,尽快将TTFields带给转移性NSCLC患者。"
Novocure致力于持续推进TTFields用于实体肿瘤患者。LUNAR临床研究是四项预计将于2024年底公布的临床III期研究中的第一项,研究TTFields用于大脑、躯干和腹部实体瘤的治疗。基于 LUNAR 数据的优势,Novocure计划启动额外的III期研究,以评估TTFields作为前线治疗,以及与ICI和其他标准治疗的联用。
除了LUNAR研究外,再鼎医药参与了2项Novocure正在开展的临床III期研究,包括METIS(非小细胞肺癌脑转移)、PANOVA-3(胰腺癌)。再鼎医药还与Novocure合作进行了EF-31胃癌临床II期研究,探索TTFields在中国胃癌治疗领域的应用。
关于LUNAR研究
LUNAR是一项III期研究,用于评估TTFields与ICI或多西他赛(实验组)联合使用与单独使用 ICI或多西他赛(对照组)治疗在含铂治疗期间或之后进展的转移性NSCLC患者的安全性和有效性。该研究主要终点是接受TTFields联合ICI或多西他赛治疗的患者的总生存期优于单独接受ICI或多西他赛治疗的患者的总生存期。次要终点是接受TTFields治疗联合ICI治疗的患者的总生存期优于ICI队列,以及接受TTFields联合多西他赛治疗的患者总生存期优于单独使用多西他赛的患者。TTFields主要用于与其他伴随的标准治疗一起使用,LUNAR设计预计出现多种临床结果,Novocure认为这些均有临床意义。
关于非小细胞肺癌在中国
肺癌是中国最常见的癌症类型,也是癌症死亡的主要原因。2022年中国肺癌新发病例约871,000例,死亡病例约767,000例1。非小细胞肺癌约占肺癌的85%,约 70%的非小细胞肺癌在初步诊断时为局部晚期或转移。与全球临床实践相似,医生根据疾病的阶段使用不同的手术、放疗和药物疗法组合来治疗非小细胞肺癌。手术可能对一部分患者有疗效,通常用于疾病的早期阶段。自1991年以来,放疗联合铂类化疗药物一直是局部晚期或转移性非小细胞肺癌的一线标准治疗。某些免疫检查点抑制剂已被批准用于非小细胞肺癌的一线治疗,并作为标准治疗被快速应用。二线治疗的标准治疗也在不断演变,可能包括对接受过免疫检查点抑制剂作为一线治疗方案的患者使用以铂类为基础的化疗、培美曲塞、多西他赛或免疫检查点抑制剂。
资料: (1)Changfa Xia, et al. Cancer statistics inChinaandUnited States, 2022: profiles, trends, and determinants.
关于再鼎医药
再鼎医药有限公司(纳斯达克股票代码:ZLAB;香港联交所股份代号:9688)是一家以研发为基础、处于商业化阶段的创新型生物制药公司,总部位于中国和美国,专注于为中国及全球患者提供治疗肿瘤、自身免疫疾病、感染性疾病和,神经系统疾病的变革性药物。我们的目标是利用我们的能力和资源努力促进全世界人类的健康福祉。











