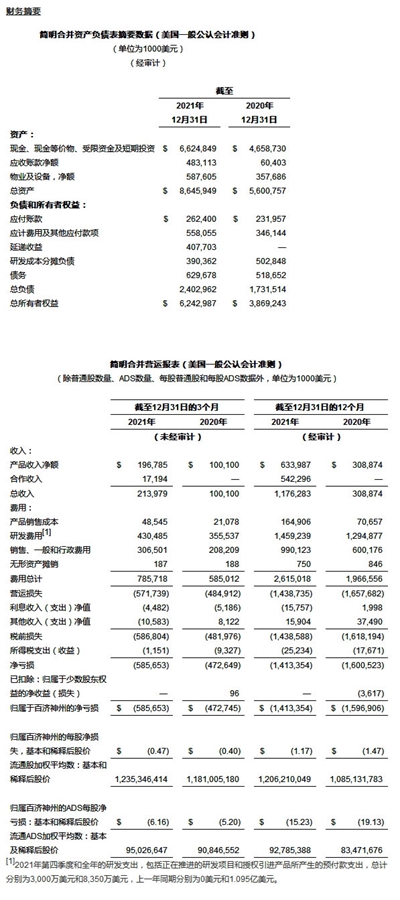
全年产品收入达6.340亿美元,相较上一年3.089亿美元,增长105.3%
百济神州联合创始人、董事长兼首席执行官欧雷强(John V. Oyler)先生表示:“2021年对百济神州而言是充满变革性的一年,我们所建立的战略性竞争优势将进一步助力我们实现公司使命,为全球患者带去更可及、可负担的创新药物。这一年,随着百悦泽®在45个市场获批,我们的产品在全球市场的覆盖范围显著提升;在中国,我们已拥有16款获批药物,其中包括已获批6项适应症的百泽安®,以及计划在完成与诺华的业务过渡后,开始在中国指定地区商业化的5款从诺华授权引进的已获批抗肿瘤药物。凭借多款核心药物,我们建立了强有力的产品组合,这将支持我们未来进一步开发更多潜在的创新疗法。其中,百悦泽®的全球化步伐势如破竹,其在美国和欧盟递交的针对最常见的成人白血病 -- 慢性淋巴细胞白血病(CLL)的新适应症上市许可申请已获受理。此外,我们持续深化与诺华富有成效的合作,进一步达成选择权、合作和授权协议,共同推进目前最领先的抗TIGIT抗体之一 -- 欧司珀利单抗(ociperlimab)的开发与商业化进程。”
2021年第四季度和全年财务业绩
2021年第四季度,现金和短期投资总额增加27亿美元;经营活动现金支出为5.078亿美元;资本支出为1.15亿美元;融资活动筹集的现金为34亿美元,几乎全部来自2021年12月15日科创板发行的募集资金净额。
2021年全年,现金和短期投资总额增加20亿美元;经营活动现金支出为13亿美元;资本支出为2.629亿美元;融资活动筹集的现金为36亿美元,主要来自2021年12月15日科创板发行的募集资金净额。
2021年第四季度产品总收入为1.968亿美元,全年产品收入为6.340亿美元。上一年同期产品总收入分别为1.001亿美元和3.089亿美元。产品收入包括:
– 百泽安®在2021年第四季度和全年在中国的销售额分别为5,440万美元和2.551亿美元。相比较,上一年同期销售额分别为6,350万美元和1.634亿美元。百泽安®在第四季度的销售额受到2022年中国国家医保药品目录(NRDL)降价的影响,产生了2,540万美元的负调整。由于本季度一些以医保前价格出售的产品仍在分销渠道中,根据中国政策要求,我们为分销渠道中以2021年医保前价格出售的存量产品向分销商进行了补偿。由于百泽安®于2021年3月和2022年1月两次被列入NRDL,2021年百泽安®全年销售额包括两次总计4,560万美元的负调整,用于分销商库存补偿。百泽安®的2020全年收入由其2020年3月在中国上市后的销售额构成;
– 安进公司授权在华销售产品在2021年第四季度和全年的销售额分别为2,030万美元和5,880万美元。相比较,上一年同期销售额分别为540万美元和850万美元。百济神州分别于2020年7月和2021年8月开始销售安进公司的安加维®(地舒单抗)和倍利妥®(贝林妥欧单抗)两款产品。
- 费用:
- 近期业务亮点
相比上一年同期,2021年第四季度产品销售额增长96.6%,全年产品销售额增长105.3%,主要得益于公司自主研发产品和安进授权引入产品的销售额增长;
2021年第四季度和全年,百悦泽®全球销售额分别为8,760万美元和2.180亿美元,相比上一年同期,分别实现了378%和423%的增长。在美国,百悦泽®第四季度销售额为5,590万美元,全年销售额为1.157亿美元,相较上一年同期分别增长539%和535%。该季度在美国的销售额取得持续增长,主要得益于在套细胞淋巴瘤(MCL)市场的持续渗透,以及近期在华氏巨球蛋白血症(WM)和边缘区淋巴瘤(MZL)适应症中取得FDA的批准。在中国,百悦泽®第四季度销售额为3,060万美元,全年为1.012亿美元,相比上一年同期,分别实现219%和331%的增长,这主要得益于包括慢性淋巴细胞白血病(CLL)在内多个已获批适应症领域的销售额显著增长;受到2021年3月和2022年1月纳入NRDL所产生的价格变化的影响,公司对分销商应计补偿分别为 440 万美元和790万美元,对百悦泽®在2021年第四季度和全年的中国销售额产生了一定负面影响;
2021年第四季度,百泽安®在中国的销售额为5,440万美元,相较上一年同期下降14%;2021年全年百泽安®在中国的销售额为2.551亿美元,相较上一年同期增长56%。第四季度,医保报销范围扩大所带来的新增患者需求、进一步扩大的销售团队以及药品进院数量的增加,持续推动了百泽安®的市场渗透率的提升和市场份额的扩大;
继续在中国指定区域( “广阔市场”)建立商业化能力以满足日益增长的医药需求。我们与诺华公司达成一项新的合作协议,百济神州取得授权推广和销售诺华已获批、并获得国家医保报销资格的5款抗肿瘤产品。这些产品包括:泰菲乐®(达拉非尼)、迈吉宁®(曲美替尼)、维全特®(帕唑帕尼)、飞尼妥®(依维莫司)和赞可达®(塞瑞替尼);
推动符合条件的药物/适应症申报并成功纳入中国国家医保药品目录(NRDL),包括百泽安®用于治疗一线非鳞状非小细胞肺癌(NSCLC)、一线鳞状NSCLC、二线或三线治疗肝细胞癌(HCC);百悦泽®用于治疗华氏巨球蛋白血症(WM);以及百汇泽®用于治疗既往接受过至少二线化疗、伴有胚系BRCA(gBRCA)突变的晚期卵巢癌、输卵管癌或原发性腹膜癌;
我们的中国商业化团队持续发力,不断将新产品带入市场,在第四季度实现凯泽百®和普贝希®的成功上市。
百悦泽®(泽布替尼):、旨在,化BTK占有率、最小化脱靶效应的小分子布鲁顿氏酪氨酸激酶(BTK)抑制剂,已在美国、中国、欧盟、英国、加拿大和澳大利亚在内的45个市场获批多项适应症,目前正在进一步临床开发,以在全球范围内取得更多上市批准。百悦泽®全球临床开发项目已在超过25个国家和地区入组近4,000例受试者。
- 百泽安®(替雷利珠单抗):、人源化 IgG4抗PD-1单克隆抗体,设计目的旨在,限度地减少与巨噬细胞中 Fcγ受体结合。百泽安®在中国已获批用于多项适应症,目前正在进一步开发,以在全球范围内获得更多上市批准。百泽安®全球临床开发项目已在超过35个国家和地区入组超过9,000例受试者。
- 欧司珀利单抗(BGB-A1217):、具有完善Fc功能的在研抗TIGIT单克隆抗体。欧司珀利单抗的全球开发项目已在25个国家和地区入组近800例受试者。
Zanidatamab是、在研针对HER2靶点的双特异性抗体,目前处于 Zymeworks公司的临床开发后期。
- 其他发展
– Mark Lanasa,医学博士,,副总裁,实体瘤首席医学官
– Kyu-Sung Lee(“Q”),,副总裁,全球技术运营和生产负责人
– Kevin Mannix,投资者关系,副总裁
– Jurij Petrin,新市场开发负责人
– 殷敏,大中华区首席商务官已完成在新泽西州霍普韦尔的普林斯顿西部创新园区的用地收购,百济神州计划将其用于建设一个占地42英亩(约17万平方米)的全新商业化阶段生产和临床研发基地。初期建设预计将于2022年内启动。此外,该基地还预留了超过100万平方英尺(约9.3万平方米)的可开发地产,用于未来的进一步拓展;
继续建设位于中国苏州的新建小分子创新药物产业化基地。第一阶段建设面积将超过5.2万平方米,固体制剂产能可达6亿片(粒)剂次,预计将于2023年完工。待基地建设完成、验收合格并获批后,预计公司在中国的小分子药物生产能力,提升至目前的6倍;
继续建设位于中国广州的世界一流的生物药生产基地,该基地目前已获批生物药产能为8,000升,新一阶段建设预计将于2022年底完工并满足GMP标准,届时总产能将达到64,000升。
百悦泽® (泽布替尼)
- 百泽安®(替雷利珠单抗)
- 欧司珀利单抗(Ociperlimab)
- 百汇泽®(帕米帕利)
- BGB-11417(BCL-2抑制剂 )
- 早期自主研发项目
- 新冠肺炎疫情影响及应对措施
百济神州是一家立足于科学的全球性生物科技公司,专注于开发创新、可负担的药物,旨在为全球患者改善治疗效果,提高药物可及性。目前公司广泛的药物组合包括40多款临床候选药物。公司通过加强自主研发能力和合作,加速推进多元、创新的药物管线开发。我们致力于在2030年前为全球20多亿人全面改善药物可及性。百济神州在全球五大洲打造了一支超过8,000人的团队。
本新闻稿包含根据《1995年私人证券诉讼改革法案》(Private Securities Litigation Reform Act of 1995)以及其他联邦证券法律中定义的前瞻性陈述,包括关于以下方面的陈述:百济神州候选药物的临床數據和获批信息;后期临床试验的开展和预期数据结果公布;其他计划的产品获批和上市;百济神州已上市产品和候选药物的预期临床开发、药政批准、其他里程碑和商业化进程;百济神州的商业化进展和营收增长;公司正在建设的生产基地预期的产能和完工时间;新冠肺炎全球大流行对公司的临床开发、药政、商业化、生产以及其他业务带来的影响;百济神州的计划和“近期业务亮点”及“预期里程碑事件”副标题下的预期事件和里程碑;以及在“关于百济神州”副标题下提及的百济神州计划、承诺、抱负和目标。由于各种重要因素的影响,实际结果可能与前瞻性陈述有重大差异。这些因素包括了以下事项的风险:百济神州证明其候选药物功效和安全性的能力;候选药物的临床结果可能不支持进一步开发或上市审批;药政部门的行动可能会影响到临床试验的启动、时间表和进展以及药物上市审批;百济神州的上市药物及候选药物(如能获批)获得商业成功的能力;百济神州获得和维护对其药物和技术的知识产权保护的能力;百济神州依赖第三方进行药物开发、生产、商业化和其他服务的情况;百济神州取得监管审批和商业化医药产品的有限经验,及其获得进一步的营运资金以完成候选药物开发和实现并保持盈利的能力;新冠肺炎全球大流行对百济神州的临床开发、监管、商业化运营、生产以及其他业务的影响;百济神州在最近季度报告的10-Q表格中“风险因素”章节里更全面讨论的各类风险;以及百济神州向美国证券交易委员会期后呈报中关于潜在风险、不确定性以及其他重要因素的讨论。本新闻稿中的所有信息仅及于新闻稿发布之日,除非法律要求,百济神州并无责任更新该等信息。
安加维®和倍利妥®为安进公司的注册商标。
萨温珂®和凯泽百®为EUSA Pharma (UK), Ltd.的注册商标。
- 早期自主研发项目
- 安进公司合作项目
- 其他合作项目











