百济神州(纳斯达克代码:BGNE;香港联交所代码:06160)是一家全球性生物科技公司,专注于在世界范围内开发和商业化创新药物。公司今日公布其近期业务亮点、预计里程碑事件以及2021年第三季度及2021年前九个月(截至9月30日)的财务业绩。
近期业务亮点及预计里程碑事件
相比去年同期,2021年第三季度产品销售额增长111%,主要得益于自主研发产品和安进公司授权产品的销售增长;
第三季度,百悦泽®全球销售额总计6580万美元,同比增长320%;美国市场销售额总计3370万美元,去年同期为570万美元,在套细胞淋巴瘤(MCL)、新近获FDA批准的华氏巨球蛋白血症(WM)和边缘区淋巴瘤(MZL)领域持续增加的市场需求,使得该季度在美销售增长继续加速;在中国,百悦泽®销售额总计3210万美元,同比增长223%,主要得益于在包括慢性淋巴细胞白血病(CLL)在内的多个已获批适应症领域的销售增长;
第三季度,百泽安®在中国的销售额总计为7700万美元,同比增长54%。该季度中,医保报销范围扩大带来的新增患者需求、进一步扩大的销售团队以及药品进院数量增加,持续推动了百泽安®市场渗透率和市场份额的扩大;
中国的商业化团队持续发力,不断将新产品带到市场,与安进公司合作的第二个产品——倍利妥®(注射用贝林妥欧单抗)成功上市。第三季度,该产品贡献了500万美元的销售额。另有两款新产品预计在年底前获批上市;
我们正在为符合条件的产品准备即将到来的国家医保药品目录谈判,包括新增一线治疗非鳞状非小细胞肺癌(NSCLC)、一线治疗鳞状非小细胞肺癌(NSCLC)和二线或三线治疗肝细胞癌(HCC)适应症的百泽安®、经治的华氏巨球蛋白血症(WM)适应症的百悦泽®,以及治疗既往接受过至少二线化疗、伴有胚系BRCA(gBRCA)突变的晚期卵巢癌、输卵管癌或原发性腹膜癌患者的百汇泽®。国家医保药品目录谈判预计在2021年第四季度完成。
百悦泽®(泽布替尼):、旨在,化BTK占有率、最小化脱靶效应的小分子布鲁顿酪氨酸激酶(BTK)抑制剂,已在美国、中国、加拿大、澳大利亚和其他国际市场获批多项适应症,目前正在进一步临床开发,以在全球范围内获得更多上市批准。
- 百悦泽®预计里程碑事件
- 百泽安®(替雷利珠单抗):、人源化IgG4抗PD-1单克隆抗体,设计目的旨在,限度地减少与巨噬细胞中Fc
- 百泽安®预计里程碑事件
将于2021年或2022年上半年公布百汇泽®用于铂敏感的复发性卵巢癌患者维持治疗的3期临床试验(NCT03519230)主要结果。
2期AdvanTIG-206临床试验(NCT04948697)已启动患者入组,Ociperlimab联合百泽安®及百奥泰公司研发的普贝希®(贝伐珠单抗生物类似药)用于一线治疗晚期肝细胞癌(HCC)患者。
将于2021年启动全球2期AdvanTIG-205临床试验(NCT05014815)的患者入组,研究一线IV期NSCLC治疗。
已于2021年启动针对伴有t(11;14)染色体易位的多发性骨髓瘤患者的1期临床试验(NCT04973605) 患者入组。
将于2022年启动关键性临床试验的患者入组。
继续推进早期临床管线中的自主研发候选药物的剂量递增阶段研究,包括BGB-A445(、作为单药或联合百泽安®治疗实体瘤的在研非配体竞争性抗OX40单克隆抗体),BGB-15025(、作为单药或联合百泽安®治疗实体瘤的在研造血干细胞激酶1[HPK1]抑制剂),BGB-10188(、作为单药或联合百悦泽®治疗血液肿瘤或联合百泽安®治疗实体瘤的在研PI3Kδ抑制剂)。
BGB-16673(、在研靶向BTK的在研嵌合降解激活复合物,简称CDAC)临床研究申请(IND)已被FDA正式批准启动临床试验。预计将在2021年启动,1期临床试验(NCT05006716)的患者给药,用于治疗B细胞恶性肿瘤患者。
BGB-A425(、在研TIM3单克隆抗体)——已启动一项联合百泽安®的1/2期临床试验(NCT03744468)的2期部分。
LUMAKRAS®(sotorasib, 、KRAS G12C抑制剂)落地海南博鳌乐城先行区,患者可在海南省定点医院申请急需用药。
宣布NMPA附条件批准凯泽百®(达妥昔单抗β)用于治疗12月龄及以上的高危神经母细胞瘤患者,这些患者既往接受诱导化疗后至少达到部分缓解,且随后进行过清髓性治疗和干细胞移植治疗,也可用于伴或不伴有残留病灶的复发或难治性(R/R)神经母细胞瘤患者。凯泽百®是、EUSA Pharma授予百济神州在中国大陆许可权的靶向免疫疗法;
得到百时美施贵宝-新基公司的通知,声称其有意终止双方达成的在中国供应ABRAXANE®(注射用紫杉醇[白蛋白结合型])的协议。百济神州对该举动提出质疑,因为百时美施贵宝-新基公司所提出的理由并非终止ABRAXANE®协议的有效依据。由于百时美施贵宝-新基公司未能按照药品生产质量管理规范(GMP)要求,持续且充足地供应ABRAXANE®,双方正在进行仲裁程序;
获得2期临床试验(NCT04551898)结果,该试验旨在评估在研新型冠状病毒(SARS-CoV-2)中和抗体BGB-DXP593(由丹序生物授权在中国境外进行开发),用于治疗轻度至中度新冠肺炎(COVID-19)患者。该试验未达到第8天鼻咽拭子病毒载量变化的主要有效性终点。根据双方签署的归还协议,百济神州已将丹序生物两款候选药物(DXP593 和 DXP604)在美国境外的授权和开发权益返还给丹序生物,百济神州保留了它们在美国的商业化权益。
在2021年欧洲肿瘤内科学会(ESMO)大会上报告了以下数据:
Sitravatinib联合百泽安®用于治疗抗PD-(L)1难治性/耐药性转移性NSCLC患者(NCT03666143);
Sitravatinib联合百泽安®用于治疗转移性NSCLC患者(NCT03666143)。
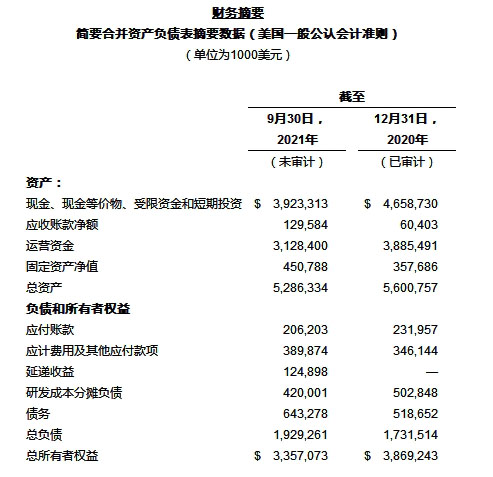
截至2021年9月30日的三个月内,经营活动现金支出为4.957亿美元,主要由于净亏损4.139亿美元,以及净经营资产和负债增加8940万美元(被非现金费用750万美元抵消后);资本支出为6700万美元;融资活动筹集的现金为1.092亿美元,主要包括向安进出售股份所得的5000万美元收入,以及员工行使股票期权。
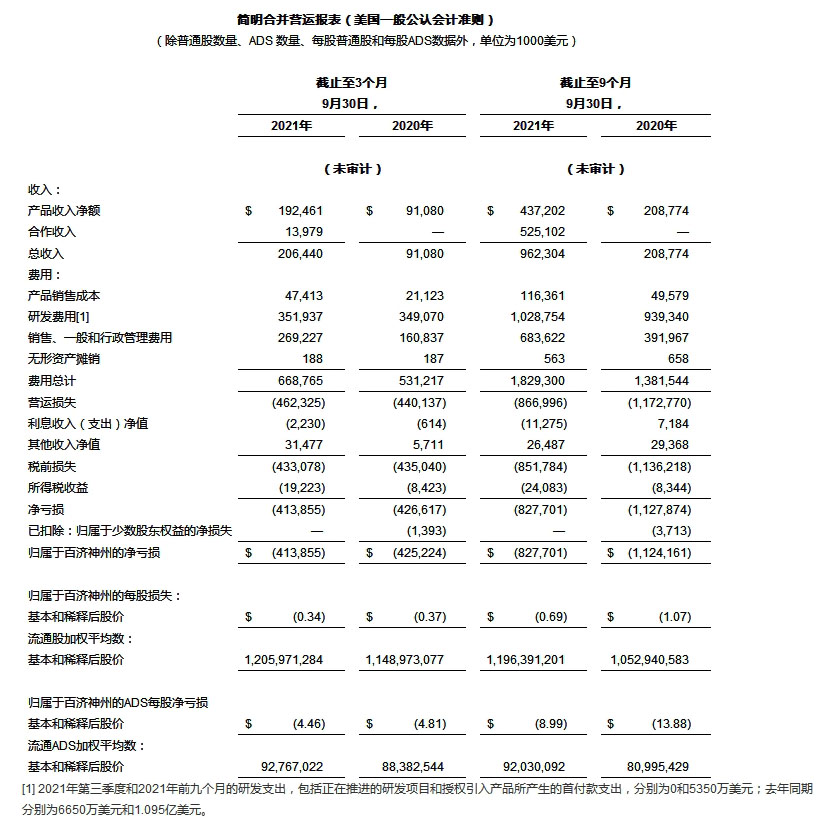
截至2021年9月30日前的3个月内,产品总收入为1.925亿美元(2020年同期数据为9110万美元),包括:
百泽安®中国销售收入7700万美元,去年同期数据为4990万美元;
百悦泽®销售收入6580万美元,去年同期数据为1570万美元;
在与安进的合作框架下,百济神州首款授权引入药物安加维®(地舒单抗注射液)在中国销售收入为1570万美元,去年同期数据为310万美元。百济神州于2020年7月上市销售该药品。
截至2021年9月30日前的三个月内,合作营收为1400万美元,主要来自于2021年第一季度与诺华的合作项目下延期偿付的部分首付款得到承兑。去年同期无合作营收。
销售成本 截至2021年9月30日的三个月内的销售成本为4740万美元,2020年同期数据为2110万美元。销售成本增加主要是由于百泽安®、百悦泽®和安加维®的产品销售量增加。
研发费用 截至2021年9月30日的三个月内,研发支出为3.519亿美元,2020年同期数据为3.491亿美元。研发费用增加主要由于员工人数增加、对外研究和开发相关活动(包括公司持续开展的自主研究和临床试验)的费用增加;部分研发费用增加已被百悦泽®相关临床试验费用降低和正在进行的研发项目相关前期费用减少所抵消。此外,在2021年第三季度,研发相关股份酬金支出为3170万美元,2020年同期数据为2540万美元。
销售、一般及行政管理(SG&A)费用 截至2021年9月30日的三个月内,SG&A费用为2.692亿美元,2020年同期数据为1.608亿美元。SG&A支出上涨主要是因为员工人数增加,以及公司打造全球布局而不断扩大全球商业团队规模的相关费用增加。此外,在2021年第三季度,SG&A相关的股份酬金支出为3540万美元,2020年同期数据为2490万美元。
净亏损 截至2021年9月30日前的三个月内的净亏损为4.139亿美元,相当于每股亏损0.34美元(美国存托股[ADS]每股亏损4.46美元);2020年同期净亏损为4.252亿美元,相当于每股亏损0.37美元(ADS每股亏损4.81美元)。
- 百汇泽®(帕米帕利胶囊):、PARP1和PARP2的选择性小分子抑制剂,在中国获得附条件批准用于既往接受过至少两线化疗、伴有胚系BRCA(gBRCA)突变的晚期卵巢癌、输卵管癌或原发性腹膜癌患者。
Zanidatamab预计里程碑事件
- 生产运营
- 新冠肺炎疫情影响和应对措施
- 企业发展
- 2021年第三季度财务业绩
百济神州公布2021年第三季度财务业绩
免责声明:本网站所刊登、转载的各种稿件、图片均有可靠的来源,市场有风险,选择需谨慎!此文仅供参考,不作买卖依据,并不代表新讯网观点,由此产生的财务损失,本站不承担任何经济和法律责任,本站自动屏蔽违反《广告法》词语。
请选择您浏览此资讯时的心情
相关资讯
- 武则天数字藏品上线半小时销售额近十万2021-11-05 10:36:40
- 联想双11首日全网销售额破30亿2021-11-04 17:41:17
- 月销售额破千万,新锐国货母婴品牌幸福继续逆袭崛起2021-11-04 17:02:32
- 广东省免疫疾病临床医学研究中心协同创新单位落户普森2021-11-04 12:11:09
- 龙牡牌便通胶囊:便秘患者的绝佳拍档,帮你和便秘说拜2021-11-03 17:22:34
今日热点推荐2013.07.01











