百济神州(纳斯达克代码:BGNE;香港联交所代码:06160)是一家全球化的生物科技公司,专注于在世界范围内开发和商业化创新药物。公司今日公布近期业务亮点、预计里程碑事件以及2021年第一季度财务业绩。
近期业务亮点及预计里程碑事件
截至2021年3月31日的三个月,公司全球产品收入共计1.061亿美元,相较去年同期的0.521亿美元,同比增长104%。第一季度的产品销售额同比去年同期以及环比上一季度均有涨幅,主要由于公司不断推进产品商业发布的进程,包括自新版国家医保药品目录(以下简称“医保”)2021年3月1日正式执行以来,百泽安®、百悦泽®以及安加维®使用患者需求大幅增加,足以抵消上述药品纳入医保后价格下调的净效应
第一季度产品收入持续增长,尽管受到一笔0.242亿美元付款的负面影响,这是由于百泽安®、百悦泽®和安加维®纳入医保后价格下调,而本季度一些以医保前价格出售的产品仍在分销渠道中,按照惯例,公司支付这笔款项用以补偿经销商,其中大部分与百泽安®相关
自百泽安®、百悦泽®以及安加维® 纳入医保以来,医院进院数量显著增加,分别达到纳入医保前的约4倍、8倍和6倍
尽管新冠疫情对患者治疗方案的影响仍在持续,疫苗接种计划,百悦泽®在美国的销售额仍保持稳定增长
百悦泽®(泽布替尼):、设计旨在,化靶点占有率、最小化脱靶效应的小分子布鲁顿酪氨酸激酶(BTK)抑制剂,在美国、中国、加拿大和其他国际市场已在特定适应症中获批,目前其在全球范围内更多审批流程正在进行中
- 百悦泽®预计里程碑事件
- 百泽安®(替雷利珠单抗):、设计旨在避免与巨噬细胞中Fc受体结合、针对免疫检查点受体PD-1的人源化IgG4单克隆抗体。百泽安®在中国已在特定适应症中获批,目前正在全球范围内为获得更多批准进行开发
于2021年上半年在中国获批用于治疗既往接受过至少两线化疗、伴有胚系BRCA突变的复发晚期卵巢癌、输卵管癌或原发性腹膜癌患者
将于2021年或2022年上半年公布帕米帕利作为针对铂敏感复发性卵巢癌(OC)患者维持治疗的3期临床试验(NCT03519230)主要结果
将在ASCO 2021年线上年会上公布临床数据,包括以下海报展示:
帕米帕利在中国用于治疗胚系BRCA突变的局部晚期或转移性HER2阴性乳腺癌患者的2期临床试验(NCT03575065)
帕米帕利对比安慰剂作为对铂类一线化疗响应的无法手术的局部晚期或转移性胃癌患者维持治疗的2期临床试验(NCT03427814)
在下列临床试验中开展患者入组:
一项ociperlimab联合百泽安®用于治疗先前接受过治疗的复发或转移性宫颈癌患者的AdvanTIG-202 2期临床试验(NCT04693234)
一项ociperlimab联合百泽安®对比百泽安®联合安慰剂用于治疗PD-L1高表达的不可切除、局部晚期、复发或转移性ESCC患者的AdvanTIG-203 2期临床试验(NCT04732494)
将在ASCO 2021年线上年会中公布一项ociperlimab联合百泽安®用于治疗晚期实体瘤患者的1期剂量递增试验(NCT04047862)的临床数据
将于2021年上半年启动一项ociperlimab联合百泽安®用于治疗PD-L1高表达且无EGFR敏感突变或ALK易位的一线局部晚期、不可切除或转移性NSCLC患者的AdvanTIG-302全球3期临床试验(NCT04746924)的患者入组
将于2021年启动一项ociperlimab联合百泽安®和同步放化疗用于治疗既往未接受过治疗的局部晚期不可切除NSCLC患者的全球3期AdvanTIG-301临床试验(NCT04866017)的患者入组
宣布一项在研造血干细胞激酶1(HPK1)抑制剂BGB-15025的1期临床试验(NCT04649385)已完成首例患者给药。BGB-15025的设计旨在成为、高活性、高选择性的HPK1小分子口服抑制剂,代表了一种创新型肿瘤免疫方案,是目前最早进入临床研究阶段的HPK1抑制剂之一
继续推动早期自主研发管线,包括BGB-11417(、针对肿瘤正处于1期临床开发的BCL-2抑制剂)、BGB-A445(、与百泽安®联合针对实体瘤目前处于1期临床开发的非配位体抗OX40单克隆抗体),以及BGB-10188(、与百悦泽®或百泽安®联合针对肿瘤目前处于1期临床开发的PI3Kδ抑制剂)
将于2021年启动一项百济神州在研BCL-2抑制剂BGB-11417针对急性髓细胞性白血病(AML)和骨髓增生异常综合症(MDS)的1期临床试验(NCT04771130)。BGB-11417的设计旨在成为、高活性、高选择性的BCL-2小分子抑制剂
将于2021年上半年启动一项BGB-A425的1/2 期临床试验(NCT03744468)的2期部分
BLINCYTO®注射用贝林妥欧单抗针对儿童复发或难治性B细胞急性淋巴细胞白血病(ALL)的sBLA已在中国被受理并纳入优先审评
截至2021年3月31日的三个月经营活动所用现金为1.251亿美元,其中包括与诺华的合作协议作为预付款收到的6.5亿美元;资本支出为0.424亿美元;支付授权药物预付款所用现金为0.85亿美元;募集资金所得现金为1.074亿美元, 其中包括银行贷款和员工认股选择权的行使
收入 截至2021年3月31日的三个月的收入为6.059亿美元;相比较,去年同期收入为0.521亿美元
截至2021年3月31日的三个月产品收入为1.061亿美元;相比较,去年同期为0.521亿美元。收入包括:
百泽安®在华产品收入为0.489亿美元;相比较,去年同期收入为0.205亿美元
百悦泽®的产品收入为0.221亿美元;相比较,去年同期收入为0.007亿美元
安进公司授权百济神州在华销售的第、产品安加维®的产品收入为0.145亿美元。公司自2020年7月开始进行安加维®销售活动
百时美施贵宝授权在华销售产品的产品收入为0.203亿美元;相比较,去年同期为0.308亿美元。本季度产品收入出现下滑,主要由于在2020年3月NMPA暂停ABRAXANE®供应后,百时美施贵宝实施了相应的产品自愿召回
截至2021年3月31日的三个月合作项目收入为4.998亿美元,主要来自诺华公司共6.5亿美元预付款收入的部分确认。去年同期无合作项目收入
费用 截至2021年3月31日的三个月费用为5.357亿美元;相比较,去年同期费用为4.258亿美元
销售成本 截至2021年3月31日的三个月销售成本为0.327亿美元;相比较,去年同期为0.141亿美元。销售成本增加主要归因于百泽安®、百悦泽®和安加维®产品销售增加,其中部分与百时美施贵宝公司授权销售产品的销量下滑相抵消
研发(R&D)费用 截至2021年3月31日的三个月研发费用为3.207亿美元;相比较,去年同期的研发费用为3.043亿美元。研发费用的增加主要归因于用于正在进行以及新启动的后期关键性临床试验持续增长的费用,新增的药物注册登记准备,以及与商业化前活动和供应相关的生产成本。2021年第一季度,授权候选药物的研发相关预付款为0.85亿美元,比去年同期的0.43亿美元减少了0.345亿美元。2021年第一季度,研发相关股权奖励支出为0.219亿美元;相比较,去年同期为0.204亿美元
销售、一般及行政管理(SG&A)费用 截至2021年3月31日的三个月销售、一般及行政管理费用为1.821亿美元;相比较,去年同期为1.071亿美元。销售、一般及行政管理费用的增加主要归因于员工人数的增加,以及公司打造全球布局而不断扩大全球商业团队规模的相关费用增加。2021年第一季度,销售、一般及行政管理相关的股权奖励支出为0.239亿美元;相比较,去年同期为0.179亿美元
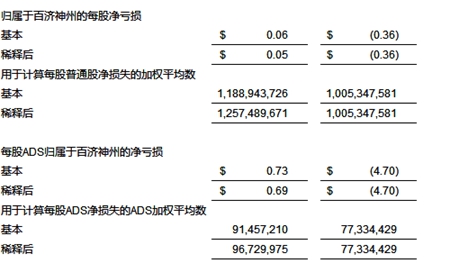
净收入 截至2021年3月31日的三个月,净收入为0.665亿美元,即每股基本及稀释后收益分别为0.06美元和0.05美元,或每股美国存托股(ADS)基本和稀释后收益分别为0.73美元和0.69美元;相比较,去年同期净亏损为3.637亿美元,即每股0.36美元,或每股ADS 4.70美元
- 百泽安®预计里程碑事件
- 帕米帕利:、在研高选择性PARP1和PARP2小分子抑制剂
Sitravatinib :、在研受体酪氨酸激酶(RTK)抑制剂,抑制TAM(TYRO3、AXL、MERTK)受体家族、分裂受体家族(VEGFR 2和KIT)和RET。百济神州获得 Mirati Therapeutics授予sitravatinib在亚洲(不包括日本)、澳大利亚和新西兰的授权
- 生产运营
- 新冠肺炎疫情影响和应对措施
- 其他发展
- 2021年第一季度财务业绩
简要合并资产负债表摘要数据(美国一般公认会计准则)
(除普通股数量、ADS 数量、每股普通股和每股ADS 数据外,单位为1000 美元)
百济神州公布2021年第一季度财务业绩
免责声明:本网站所刊登、转载的各种稿件、图片均有可靠的来源,市场有风险,选择需谨慎!此文仅供参考,不作买卖依据,并不代表新讯网观点,由此产生的财务损失,本站不承担任何经济和法律责任,本站自动屏蔽违反《广告法》词语。
请选择您浏览此资讯时的心情
相关资讯
- 猿辅导以雄厚实力打造优质产品,深受学员欢迎2021-05-06 18:38:36
- Wake Power 首次在2021深圳唤醒咖啡节亮相 咖啡产品好2021-05-06 17:53:54
- 绵阳西部冷都农副产品批发市场电商平台的发展2021-05-06 12:45:36
- 跨领域探访:仁树医疗联合多家医疗机构,为患者治疗提2021-05-06 10:46:32
- 阿特拉斯科普柯ZD无油螺杆式压缩机全系列产品实现本地2021-05-06 10:36:54
今日热点推荐2013.07.01